近日,Nucleic Acids Research发表了题为 “A temperature-driven DNA discrimination strategy to distinguish E. coli DNA and phage 5hmC-modified DNA” 的研究论文(DOI: 10.1093/nar/gkaf501)。该工作系统揭示了一种温度驱动的DNA识别机制,提出了细菌与噬菌体在长期共进化过程中围绕同一分子机制展开“共源对抗”的新范式,具有重要的理论意义与潜在应用价值。
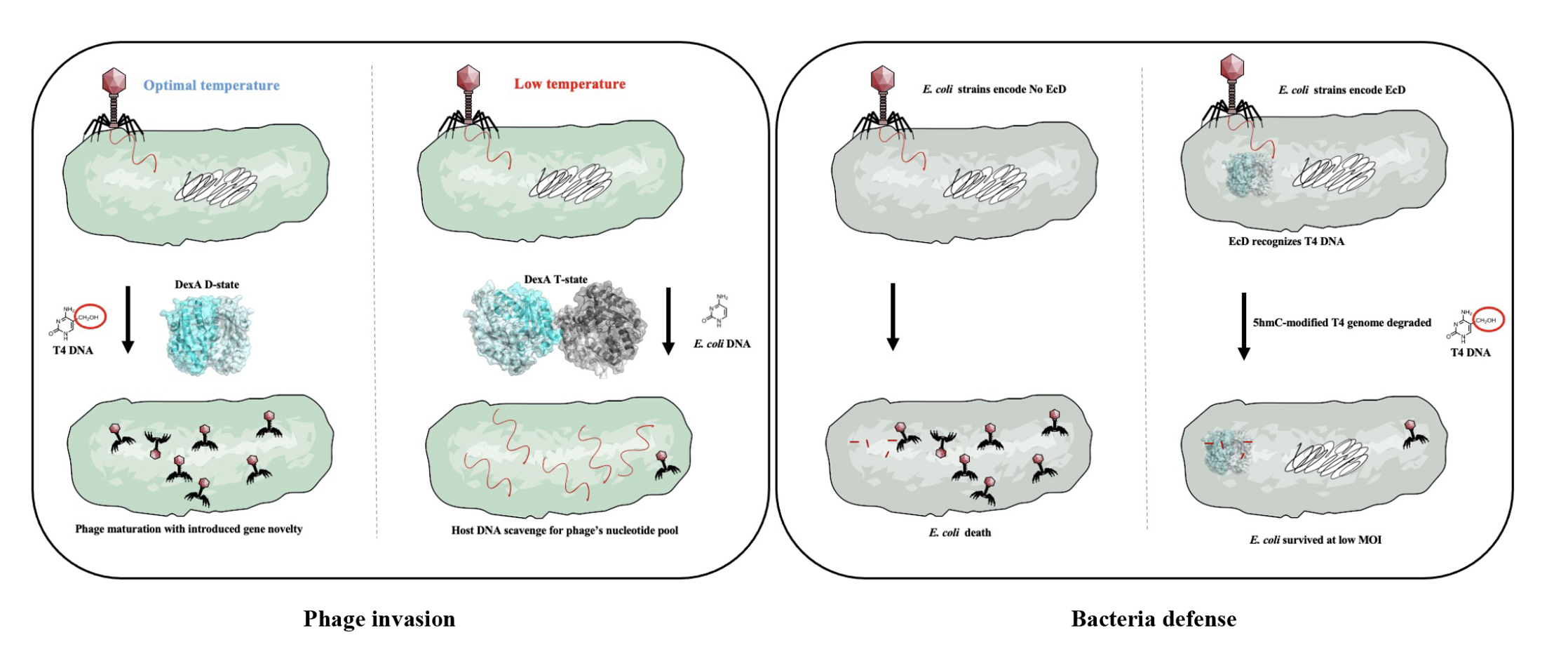
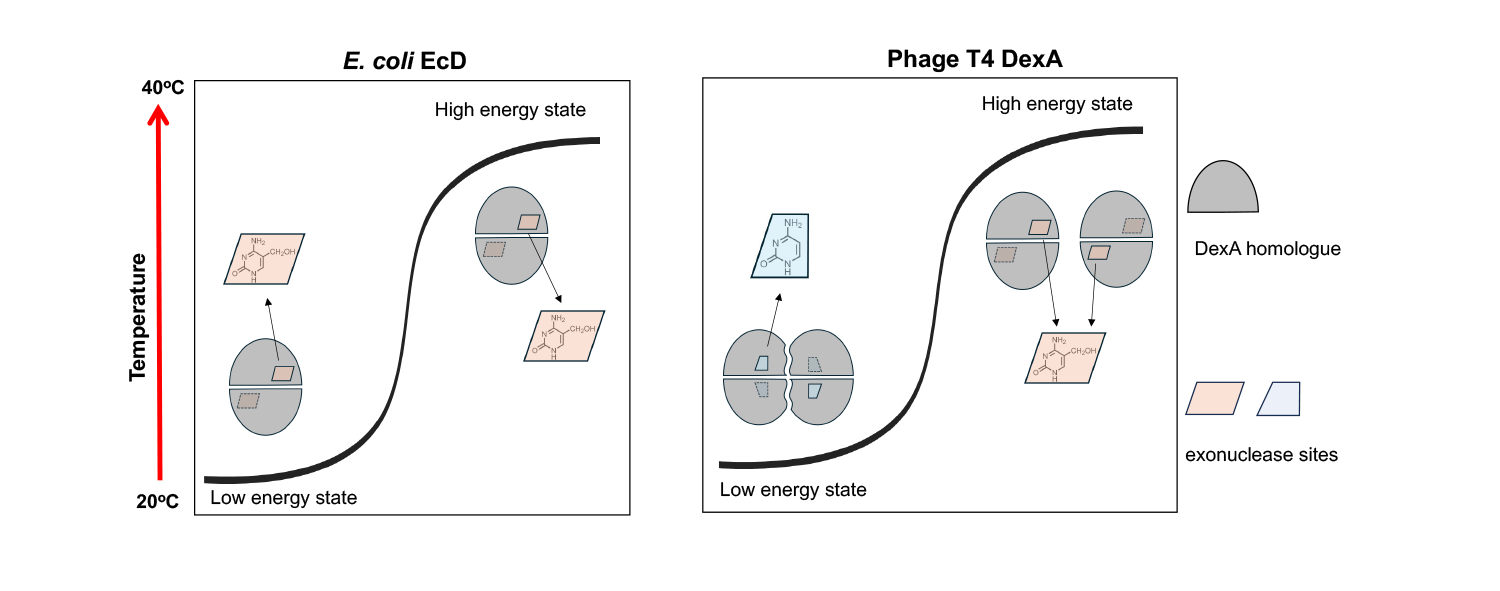
研究发现,T4噬菌体编码的外切酶DexA能通过温度感应在二聚体与四聚体之间动态切换,从而精准识别不同修饰状态的DNA底物:在低温(25°C)下,DexA以四聚体形式活跃,偏好降解未修饰的大肠杆菌DNA;而在体温(37°C)时,DexA以二聚体形式存在,专一识别并切割5-羟甲基胞嘧啶(5hmC)修饰的T4自身DNA,参与基因组重组。这一机制使噬菌体在不同环境温度下,灵活实现资源获取与基因调控的双重功能。
更为重要的是,研究进一步发现,大肠杆菌自身也进化出一种DexA的同源外切酶EcD,其构象稳定为二聚体,专一靶向5hmC修饰的噬菌体DNA,从而形成了对T4噬菌体的防御机制。这种“宿主与病毒共用结构模块、执行对立功能”的现象,体现出分子进化中的高度趋同性与策略对抗性。研究团队据此提出并定义了HREX系统(HmC-Recognizing EXonuclease),为细菌与噬菌体之间的“分子军备竞赛”提供了全新认知框架。
该研究由西安交通大学第一附属医院刘冰教授牵头完成,获得国家重点研发计划、国家自然科学基金和中央高校基本科研业务费专项资金的资助。西安交通大学第一附属医院生物样本信息资源中心为研究提供了核磁共振波谱仪的实验机时。
该项研究不仅深化了对宿主-噬菌体分子互作机制的理解,也为未来在微生物资源利用、合成生物学与发酵工业中构建抗噬菌体污染的新策略提供了潜在工具与理论支持。
